-
Notifications
You must be signed in to change notification settings - Fork 1
sekwencje wstęp
-
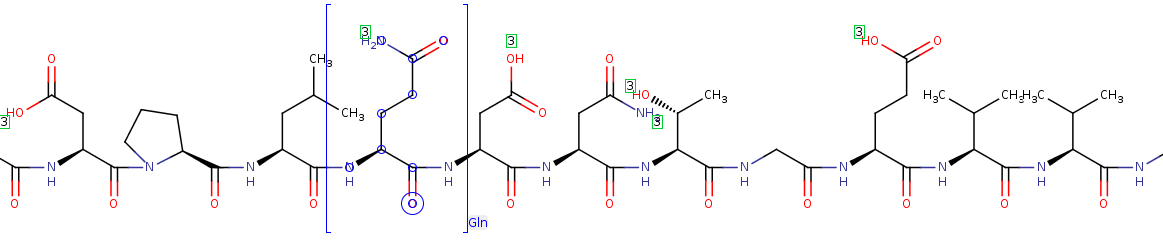
Aminokwasy
-
Aminowkasy - kod trójliterowy:

-
Kod jednoliterowy:
AFEDRDPTQFEERHLKFLQQLGKGNFGSVEMCRYDPLQDNTGEVVAVKKLQHSTEEHLRDFEREIEILKSLQHDNIVKYK GVCYSAGRRNLKLIMEYLPYGSLRDYLQAHAERIDHIKLLQYTSQICKGMEYLGTKRYIHRDLATRNILVENENRVKIGD FGLTKVLPQDKEYYKVKEPGESPIFWYAPESLTESKFSVASDVWSFGVVLYELFTYIEKSKSPPAEFMRMIGNDKQGQMI VFHLIELLKNNGRLPRPDGCPDEIYMIMTECWNNNVNQRPSFRDLALRVDQIRDQMAG
Sekwencjonowanie białka – ustalenie sekwencji aminokwasów w łańcuchu peptydowym białka.
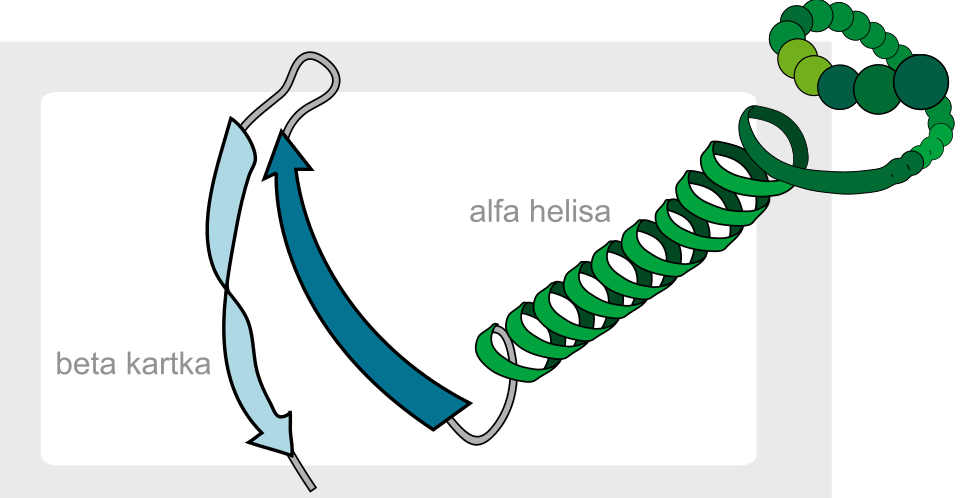
Określa się tu sposób przestrzennego ułożenia łańcuchów polipeptydowych białek na skutek powstawania wewnątrzcząsteczkowych wiązań wodorowych przede wszystkim między atomami tlenu grup amidowych i atomami wodoru innych grup amidowych. Łańcuchy polipeptydowe białek mogą układać się w kształt:
- helisy – helisy alfa (na jeden zwój heliksu przypada 3,6 aminokwasów, co odpowiada 0,54 nm[1])
- pofałdowanej płaszczyzny – harmonijka beta
- beta zakrętu (pętle omega)
Do zobrazowania struktury drugorzędowej używa się w modelu wstęgowym charakterystycznych strzałek (dla harmonijki beta) oraz helis (dla helisy alfa). wikipedia
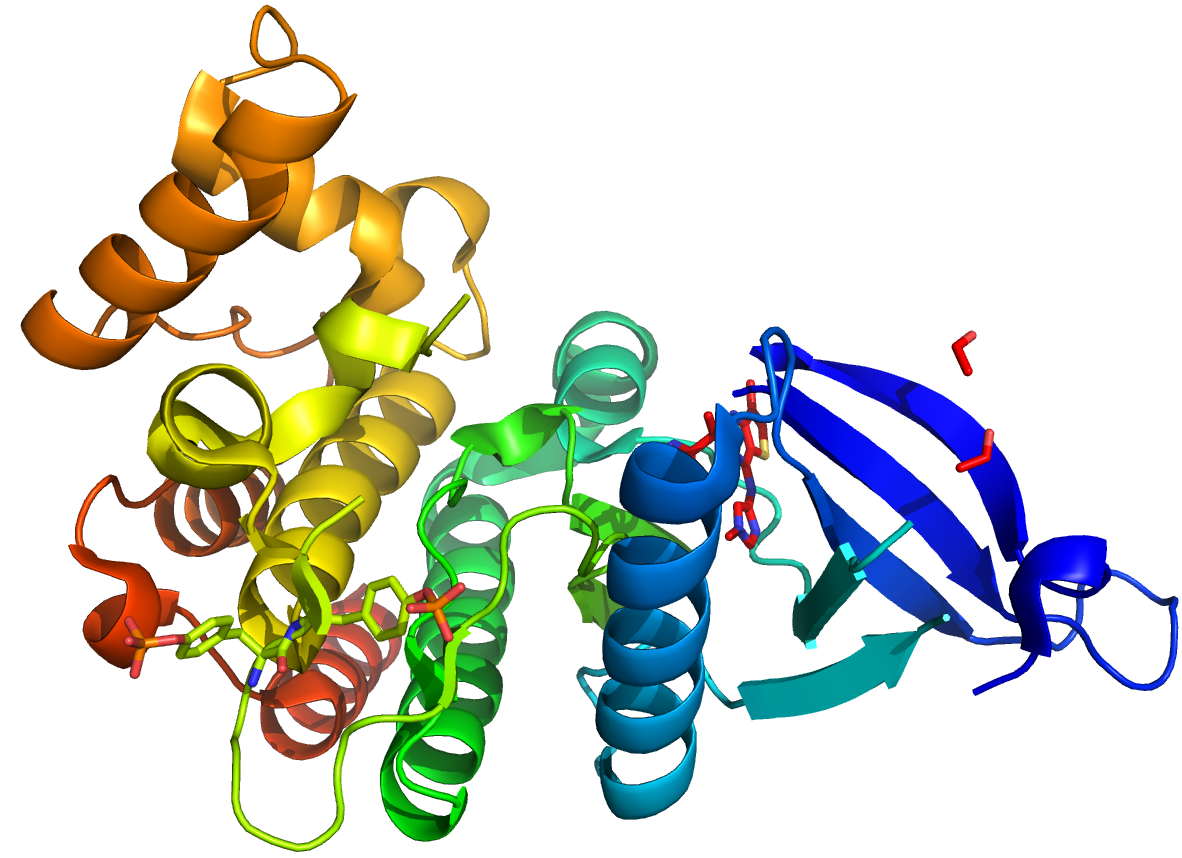 PDB code: 4C61
PDB code: 4C61
Określa się tu wzajemny układ w przestrzeni elementów struktury drugorzędowej, bez uwzględniania zależności od sąsiednich cząsteczek. Kształt, wielkość i właściwości danej podjednostki decydują o aktywności biochemicznej, w tym o działaniu enzymu. Warunkują ją różne wiązania chemiczne oraz oddziaływania międzycząsteczkowe np.:
- Wiązania dwusiarczkowe (mostki disulfidowe) – należą one do najsilniejszych wiązań między resztami aminokwasów. Powstają w wyniku odwodornienia grup tiolowych -SH dwóch cystein znajdujących się w tym samym łańcuchu białkowym. Wiązania te nadają trwałość strukturze trzeciorzędowej.
- Oddziaływania jonowe – mogą występować między zjonizowanymi formami grup aminowych lub guanidynowych łańcuchów bocznych aminokwasów zasadowych, a grupami karboksylanowymi aminokwasów kwaśnych (Asp, Glu).
- Oddziaływania hydrofobowe – polega na odpychaniu cząsteczek wody.
- Oddziaływania van der Waalsa
Należy jednak podkreślić, że spora część białek (od 3% do ponad 30% w zależności od organizmu[1]) w całości lub częściowo pozbawiona jest stabilnej struktury trzeciorzędowej. W komórce występują one jako białka w sposób ciągły zmieniające strukturę adaptując się w ten sposób do środowiska. wikipedia
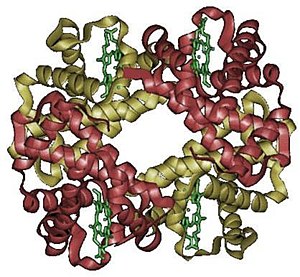
poziom organizacji na którym można opisać budowę białka. Określa się tu wzajemny układ w przestrzeni oraz sposób połączenia się:
- podjednostek, czyli osobnych łańcuchów polipeptydowych, niepołączonych ze sobą kowalencyjnie lub
- grup prostetycznych (w przypadku białek złożonych).
Tylko część białek tworzy strukturę czwartorzędową. Jeżeli jednak jest w stanie tworzyć to dopiero komplet podjednostek wykazuje aktywność biologiczną.
Computer Aided Drug Design @ Politechnika Warszawska, Filip Stefaniak
